9月11日,中國國家藥監局藥品審評中心(CDE)官網公示,信達生物(01801)申報的1類新藥IBI334獲得臨牀試驗默示許可,擬用於治療不可切除、局部晚期或轉移性實體瘤患者。根據信達生物公开資料,IBI334是全球首款獲EGFR/B7-H3雙抗。ClinicalTrials官網顯示,信達生物正在开展IBI334針對不可切除、局部晚期或轉移性實體瘤患者的1期研究。
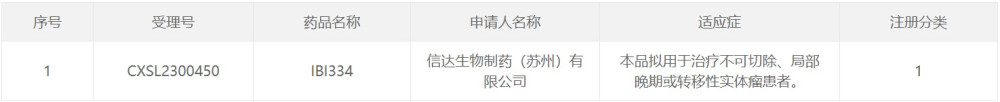
截圖來源:CDE官網
據文獻報道,EGFR(表皮生長因子受體)和B7-H3是兩種在許多癌症類型中過度表達的分子,它們都被認爲是抗腫瘤免疫反應的重要抑制因素。EGFR是一種酪氨酸激酶受體,它參與細胞增殖、分化及存活過程中重要的信號轉導途徑,異常的EGFR信號可能導致細胞過度增殖和腫瘤發生。B7-H3則是一種免疫檢查點分子,它的功能主要是阻止T細胞的激活和擴增,從而避免免疫系統過度反應。
EGFR/B7-H3雙抗是針對這兩種分子的靶向藥物,一方面可以通過抑制EGFR信號阻斷腫瘤細胞的增殖,另一方面通過阻斷B7-H3信號激活T細胞,增強其對腫瘤細胞的攻擊。因此,EGFR/B7-H3雙抗療法的作用機制主要是通過同時抑制腫瘤生長並增強免疫系統的殺傷力,以達到對腫瘤的雙重打擊。
雙特異性抗體是信達生物的主要研究領域之一。公开資料,除了本次獲批臨牀的EGFR/B7-H3雙抗,該公司還有其它多款雙抗產品已經進入臨牀研究階段,針對的適應症主要爲腫瘤、眼科疾病。
摩根士丹利認爲,信達生物上半年業績好過預期,主要受惠經營开支改善。該行指出,由信達與禮來共同合作的肺癌藥Tyvyt第二季銷售同比升41%,已復蘇至2021年第二季水平。該行估計下半年來自肺癌免疫療法Sintilimab的銷售額13億元,相信第二季的強勁復蘇將會持續,有可能上調銷售預測。維持信達生物“增持”評級,目標價由56港元上調至59港元。
本文作者可以追加內容哦 !
標題:信達生物(01801)EGFR/B7-H3雙抗獲批臨牀
地址:https://www.utechfun.com/post/261382.html
