7月21日,吉利德宣布,CD47單抗Magrolimab聯合阿扎胞苷治療高風險骨髓增生異常綜合徵(MDS)的三期ENHANCE研究因計劃分析結果無效而終止。
Magrolimab丟失預期也不是第一次。2022年1月,由於研究人員報告的可疑意外嚴重不良反應在各研究組間存在明顯的不平衡,FDA就部分暫停了吉利德Magrolimab+阿扎胞苷的聯合研究。
在吉利德Magrolimab跨過CD47單抗安全性質疑的檻後,在三期臨牀卻因療效不足而終止臨牀,這無疑對於在研CD47抗體的賽道玩家潑了一把冷水。
不過,吉利德Magrolimab作爲全球第一代CD47抗體,其受挫不禁讓市場投資者更加期待迭代CD47抗體的未來。
01 CD47,研發路上意想不到荊棘滿地
巨噬細胞是一種廣泛分布於全身血液、組織的免疫細胞,能夠吞噬和殺滅胞內寄生蟲、細菌、腫瘤細胞、以及自身衰老和異常的細胞,在人體免疫系統中發揮重要作用。
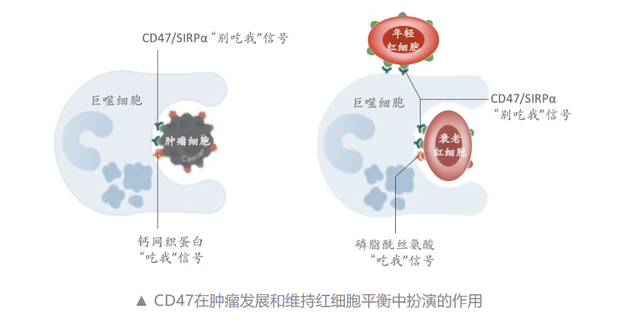
CD47是調節巨噬細胞吞噬功能的最有前景的靶點之一,由於CD47在於腫瘤細胞上高表達,能夠向巨噬細胞傳遞“別喫我”信號(與巨噬細胞表面的SIRP結合),並战勝腫瘤細胞上表達的“喫我”信號(如鈣網織蛋白等),從而屏蔽巨噬細胞的吞噬功能。
因此,CD47抗體通過阻斷CD47/SIRP信號通路,就可以恢復巨噬細胞對腫瘤細胞的吞噬。
(圖源:德石資本)
事實上,阻斷CD47/SIRP信號通路就能抑制腫瘤的愿望僅僅是理想狀態下的美好愿望。
CD47同時主導紅細胞在體內的清除和平衡,正常細胞表面(尤其是紅細胞)CD47同樣大量表達,CD47藥物有可能在到達腫瘤細胞前就被紅細胞消耗殆盡;一方面如果CD47抗體與紅細胞表面的CD47大量結合,將引起紅細胞凝集並導致紅細胞裂解,另一方面抗體激活巨噬細胞吞噬紅細胞,造成貧血或血小板減少等問題。
針對血液毒性問題,全球各路藥企也展示了不同的應對方案。
第一種是以吉利德爲代表的預激給藥。
在CD47抗體治療中,預激給藥策略指最初給予患者一個較低的“預激”劑量,目的在於選擇性地清除壽命接近尾聲、在體內大量表達CD47的衰老紅細胞(對年輕的、CD47表達少的紅細胞影響較小,之後再給予常規大劑量的CD47單抗,此時全身的CD47已經大大減少,因此能夠更精確地瞄准腫瘤細胞,避免一开始高劑量注射造成大範圍血細胞損傷。
這種方法的不利因素在於幾方面:1)對某些患者無效;2)確定預激給藥劑量需要在有效性和安全性上找平衡;3)預激給藥需要二次或者多次給藥,可能降低了依從性。
第二種是結構改良。
目前全球常用的策略是降低CD47藥物與紅細胞的結合能力。大量臨牀數據表明:开發Fc端爲IgG4型的CD47抗體能夠比Fc端爲IgG1型的CD47抗體,擁有對紅細胞、血小板更小的影響。
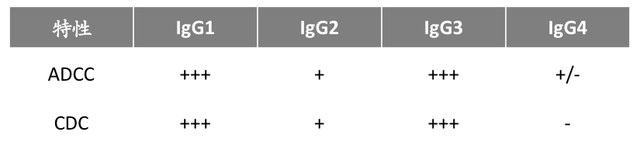
(不同IgG抗體亞型在ADCC和CDC效應上的差異 圖源:德石資本)
以天境生物的CD47來佐利單抗爲例,其設計思路爲在選擇IgG4亞型抗體的同時,加入了降低CD47藥物與紅細胞結合能力的設計。利用獨有的人源天然噬菌體技術,天境生物篩選出了可以結合在稀有表位上的CD47抗體,降低與紅細胞的結合,解決血液毒性副作用的問題。
但這種方法的弊病在於:IgG1 Fc可向巨噬細胞傳遞較強的“喫我”信號,而IgG4 Fc則傳遞適中的信號,這將大幅削弱CD47單抗對於腫瘤細胞的殺傷能力。
除該方法之外,還有部分藥企通過將CD47改成雙抗來解決血液毒性問題,如信達生物开發了PD-1/CD47雙抗,一方面用PD-1來鎖定腫瘤細胞,另一方面利用CD47/SIRP信號通路讓巨噬細胞過來進行吞噬。
02 高風險下的大機遇
目前,CD47靶點藥物最核心的適應症是骨髓增生異常綜合徵(MDS)。
MDS是一組異質性的造血幹細胞疾病,又被稱爲“白血病前期”,其特徵是骨髓、紅細胞和巨核細胞祖細胞的發育異常,導致骨髓不能正常生成血細胞,出現外周血全血細胞減少、骨髓細胞增生以及病態造血,約1/3的MDS患者可進展爲急性髓系白血病(AML)。當前,MDS治療方案仍比較有限,患者多因細胞減少症相關的並發症或AML而死亡。
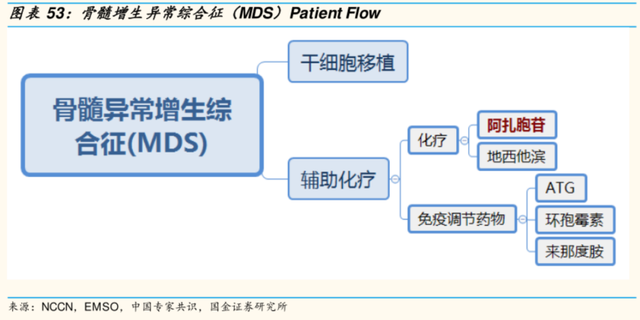
目前,中國MDS年發病率約1.5人/10萬人,每年新發患者數量約2萬人。以目前常用的藥物阿扎胞苷爲例,國內藥物市場至少在10億以上量級。
流行病學顯示,美國MDS新發1.5萬例/年,死亡7000例/年,疾病具有迫切未滿足臨牀需求。據推算,高危MDS預期市場規模爲10-20億美元。
CD47藥物的天花板絕不僅限於MDS,以吉利德的CD47爲例,其拓展的適應症不僅包括血液瘤中的MM(多發性骨髓瘤)、彌漫性大B細胞淋巴瘤、AML等,還拓展至實體瘤領域(頭頸癌、三陰乳腺癌等)。
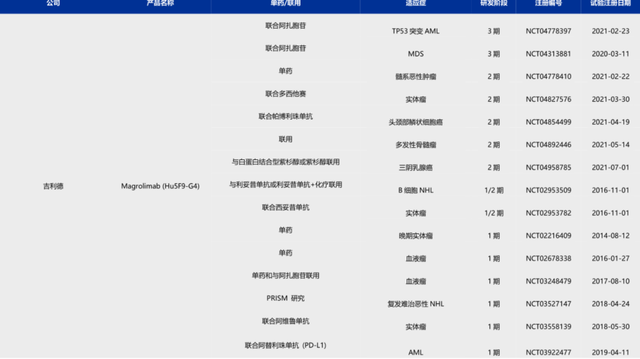
(吉利德CD47適應症拓展 圖源:申萬宏源香港)
除腫瘤適應症外,海外有部分Biotech發現CD47/SIRP通路治療心血管疾病的潛力,如Bitterroot利用靶向CD47/SIRP通路動脈粥樣硬化,原理是動脈粥樣硬化組織中比正常血管組織存在更多CD47。
CD47藥物所展現出的治療廣譜性,使得這個領域不缺乏重磅交易或者賺錢效應。
最經典案例莫過於吉利德49億美元收購FortySeven,FortySeven自2019年12月在ASH會議上公布CD47抗體的MDS和AML積極數據後,股價一路高歌,4個月內上漲超過5.6倍。
天境生物2020年初在美國上市,隨後因爲艾伯維與其達成CD47單抗總額近30億美金的重磅交易,使得公司在短短不到兩年的時間內股價上漲超過5倍。
可見,MNC巨頭們充分看到了CD47抗體所蕴含的巨大價值。
03 最具潛力的CD47抗體:康方生物的AK-117
梳理全球靶向CD47藥物進度,可以發現吉利德、天境生物、康方生物走在最前列(信達生物CD47海外臨牀處於1/2期)。不過,吉利德先是在早年間遭遇了因血液毒性被FDA暫停臨牀,天境生物則是因爲與艾伯維的合作生變而導致臨牀進度緩慢。康方生物的AK-117,則是完成了國內二期臨牀後,因療效&安全性優異,目前正籌備全球臨牀大三期(管理層口徑CDE與FDA溝通順利)。
在國內,信達生物、天境生物的CD47走在前列,均處於臨牀三期。
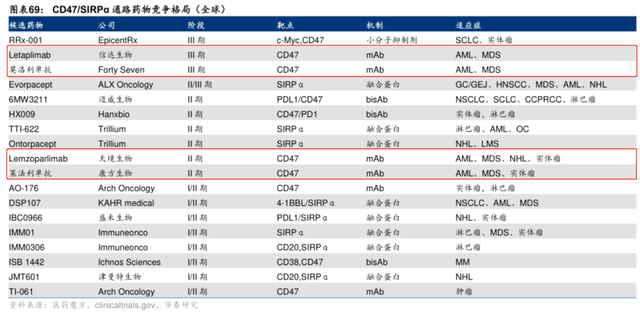
但從目前看來,康方生物的AK-117是第一梯隊中最有潛力成藥的分子之一。
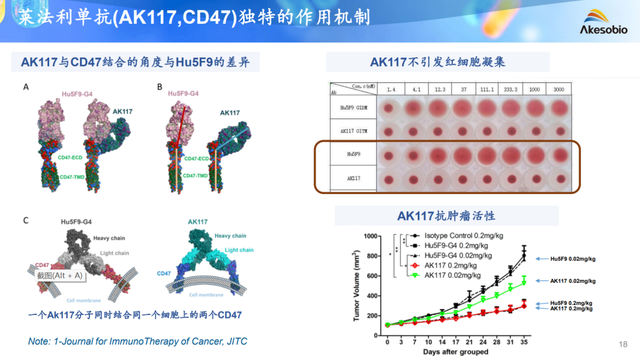
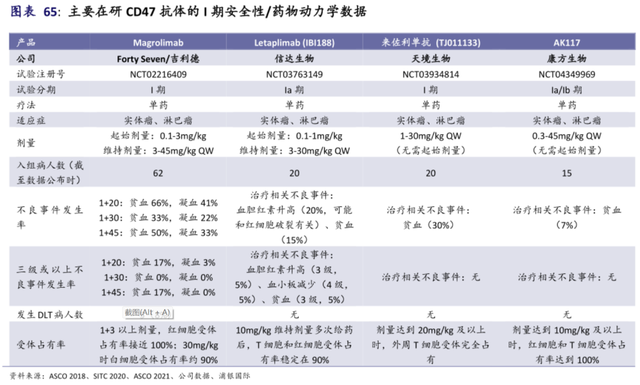
AK-117最突出的特點在於其安全性,已有的臨牀前數據表明:其不會引起血小板毒性和紅細胞聚集,對食蟹猴貧血的發生影響很小;臨牀一期數據表明:15例實體瘤患者中未觀察到與注輸相關的不良反應和嚴重不良反應。
信達的IBI188的一期臨牀數據顯示:20例受試者中,其貧血發生率在15%,出現3例3/4級不良反應事件。
另外,從幾大CD47單抗的臨牀一期數據可以看到,天境生物、康方生物的分子安全性較信達、吉利德更優;如果從劑量爬坡角度考慮,AK-117劑量爬坡區間上限在45mg,高於天境生物的來佐利單抗,可以初步判斷是療效和安全性平衡做的最佳的分子。
市場投資者的的目光可能被康方生物的兩大雙抗所吸引,CD47以優秀的設計漸漸從群狼中脫圍而出,成爲潛在“FIC 或BIC”產品,彰顯康方生物在雙抗以外領域的預期差。
今年7月,康方生物申報了AK132注射液(CLDN18.2/CD47)的IND,這也是公司利用CD47靶點瞄准胰腺癌的重要布局;CLDN18.2、CD47均於胰腺癌的高表達,同時90%胰腺癌中高表達的KRAS信號與CD47緊密相關。
康方生物或許能從對CD47靶點的理解積累,在雙抗及更新型的藥物形式獲得不一樣的優勢。
結語:盡管CD47靶點領域目前遭遇了層層挫折,但在藥物研發行業往往風險與收益成正相關,最終順利摘桃子的藥企所獲得的市值加成,一定難以想象的。$康方生物(HK|09926)$$信達生物(HK|01801)$$天境生物(NASDAQ|IMAB)$
本文作者可以追加內容哦 !
標題:巨頭49億美元收購踩雷,國內幾家Biotech爭奪全球First in class
地址:https://www.utechfun.com/post/242270.html
