醫藥行業正式進入“兩會時間”,從政府工作報告开始。
近日,於北京开幕的十四屆全國人大二次會議上,政府工作報告明確提出,“鞏固擴大智能網聯新能源汽車等產業領先優勢,加快前沿新興氫能、新材料、創新藥等產業發展……”
藥界沸騰。這是“創新藥”一詞,首次進入政府工作報告,充分表明了國家對創新藥的決心及信心。
事實上,隨着國內創新藥的迅猛發展,中國醫藥創新力量已然綻放於國際舞台,創新藥頻頻出海,發出中國創新藥的時代強音。
當國產創新藥的“出海”命運的齒輪开始轉動,中國創新藥企們,如何帶領國產創新力量邁上新台階?又有哪些中國創新藥企成爲出海大潮的“排頭兵”?
01
恆瑞醫藥,
勇扛出海大旗
談到國產創新藥企,必然離不开“醫藥一哥”恆瑞醫藥。
2023年,$恆瑞醫藥(SH600276)$落地了5項license out合作,在國際舞台“大殺四方”。
其中,與默克達成最高14億歐元的BD交易,是恆瑞首次與MNC巨頭達成的战略合作,包括PARP1抑制劑HRS-1167在中國大陸以外的獨家權益、Claudin-18.2 ADC藥物SHR A1904在中國大陸以外的獨家選擇權,以及兩款藥物在中國大陸與恆瑞共同商業化的選擇權。
恆瑞通過BD加速出海的背後,是由新任的首席战略官江寧軍所推動,後者於2023年1月走馬上任,負責公司創新藥國際化、臨牀研究和商務拓展工作。
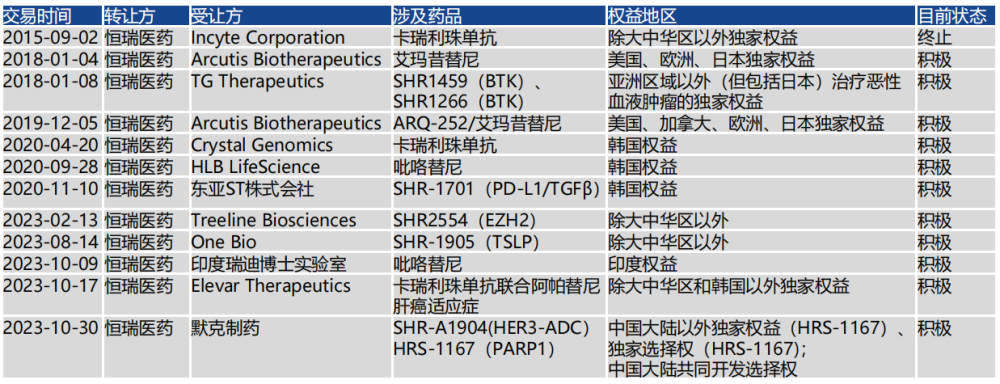
恆瑞醫藥License out產品
圖片來源:國海證券
除與海外藥企聯手實現“借船”出海外,恆瑞也在嘗試通過自身實力在海外开展臨牀試驗、申報上市,實現“造船”出海。
財報顯示,恆瑞已在美國、歐洲、澳大利亞、日本和中國多地建有研發中心,形成各有特長、功能互補的全球研發體系,目前有近20款管线在海外开展臨牀試驗,覆蓋抗腫瘤、血液、風溼免疫和呼吸系統等多個治療領域。
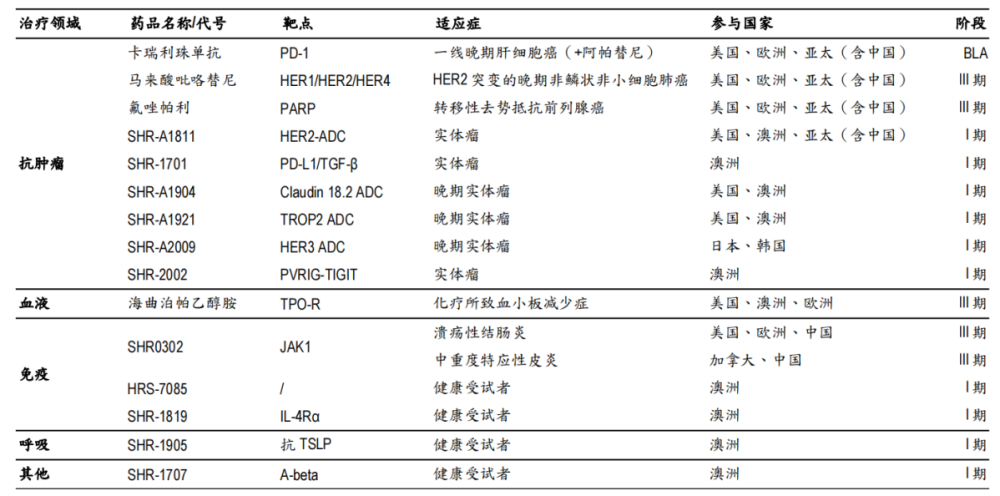
恆瑞醫藥創新藥海外研發管线
圖片來源:交銀國際
02
百濟神州:
徵战全球市場
2023年,徵战全球市場的“創新藥一哥”$百濟神州-U(SH688235)$,交出了亮眼的成績單。
其中,BTK抑制劑澤布替尼全球銷售額達13億美元,同比增長138.7%,首次突破十億美元大關,成爲國產首款“重磅炸彈”藥物;替雷利珠單抗全年銷售額達5.37億美元,同比增長33.1%,並且在歐盟、英國獲批上市,實現了國產PD-1單抗出海“零的突破”。
尤其2023Q4,美國澤布替尼強勢增長,首次超越中國成爲百濟最大的產品銷售收入貢獻地區;2023全年,美國收入佔總收入的45.9%,較去年同期上升了10.4個百分點。
3月1日,百濟宣布替雷利珠單抗在美國申報上市的第3項適應症(一线治療胃癌)上市申請已獲FDA受理,預計今年內獲批上市。這意味着,百濟的兩大基石藥物全部走向國際市場,在海外徵程之路寫下了濃墨重彩的一筆。
爲拓展國際市場,百濟採取了“對外授權合作+自建國際商業化團隊”雙管齊下的策略。
徵战全球市場,考驗的是藥企全方位的實力,包括研發、生產、市場營銷以及法規遵從與國際化能力等。但打造這一綜合實力,既需要時間,也需要大量投入。
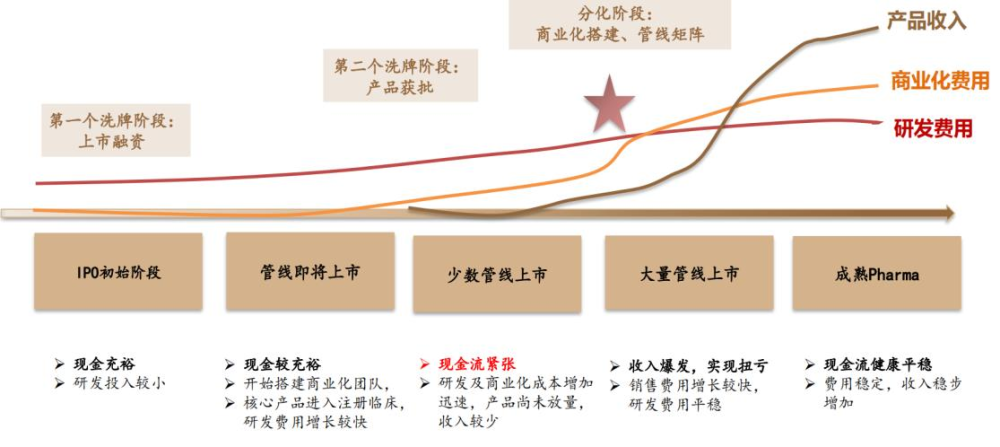
Biotech成長路徑,已進入分化期
圖片來源:德邦研究所
在全球商業能力羽翼尚未豐滿時,藥企往往通過License out策略實現“借船出海”。由此,百濟於2021年1月將替雷利珠單抗在美國、加拿大等10多個國家的海外商業化權益,以總交易金額超22億美元(其中首付款6.5億美元)授予諾華。
除授權“出海”外,百濟還前瞻性的建立了全球化的銷售團隊和臨牀开發能力,打造了一支規模超過3500人的國際商業化團隊,以及超過3000名員工全球臨牀开發和醫學事務團隊。總裁吳曉濱表示,“百濟在主要的國家都已經有銷售團隊,包括市場准入、政府事務、醫保、商業保險。”
也正是基於這層背景,百濟得以在全球市場开疆拓土。
目前,澤布替尼已在美國、歐盟等超過65個市場獲批多項適應症;替雷利珠單抗正在接受美國和歐洲等10個國家和地區監管機構的審評,而且百濟還重新獲得了該藥的全球權益,加強了公司在實體腫瘤領域的全球產品組合。
更重要的是,澤布替尼之所以能成爲“十億美元分子”,是由於在頭對頭試驗中完勝強生/艾伯維的伊布替尼,驗證了全球“同類最佳”的優勢。而與海外藥企進行頭對頭PK,正是國產藥企徵战全球市場的一個重要環節。
可見,百濟在全球市場的成功絕非偶然,在積極“走出去”的战略規劃中,無論是與海外藥企合作還是自建國際商業化團隊,“出海”策略的重要性不言而喻。
03
和黃醫藥、康方生物,
授權“出海”成果顯著
百濟神州能從Biotech逐步成長爲Big pharma,離不开背後雄厚的資金實力。
可對於大多數現金流並不充裕的中小型創新藥企來說,採取License out“借船出海”的模式更爲穩妥。
畢竟,這種策略不僅能讓國產藥企提前獲取現金流,還可以快速進入全球市場,降低市場准入門檻和風險。同時,通過與當地藥企或跨國制藥巨頭的合作,還能借助其渠道和資源優勢,提升創新藥物的市場推廣效果。
和黃醫藥、康方生物正是借助授權“出海”,實現了首次年度盈利。
其中,2023年$和黃醫藥(HK|00013)$實現營收8.38億美元,同比增長96.52%,實現淨收益1.01億美元,爲成立23年以來首次實現盈利;康方生物預期2023年度將錄得利潤不低於人民幣18.5億元,實現自創立以來的首次年度盈利。
在和黃醫藥2023年營收中,有近四成來自BD交易。報告期內,腫瘤和免疫業務綜合收入達5.286億美元,其中有2.8億美元來自日本武田就呋喹替尼的全球權益支付的首付款合作收入,以及取得FDA批准後3200萬美元的裏程碑款收入。
2023年1月,和黃醫藥將呋喹替尼除中國內地、香港及澳門以外的全球權益授予日本武田,將獲得不超過11.3億美元的總交易額(首付款4億美元)。目前,呋喹替尼不僅獲得美國FDA批准上市,用於治療經治轉移性結直腸癌成人患者,還在積極推進歐洲、日本等市場的商業化。
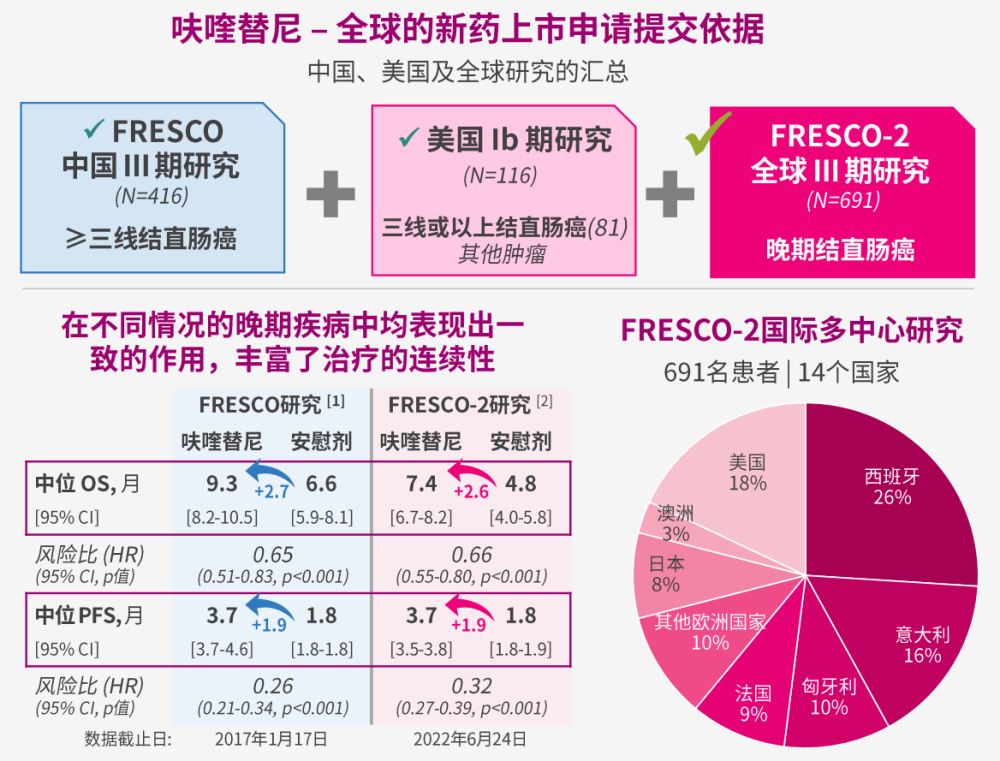
呋喹替尼全球新藥上市申請匯總
圖片來源:和黃醫藥2023年中報投資者PPT
康方生物之所以能扭虧爲盈,除了PD-1/CTLA-4雙抗卡度尼利單抗銷售收入穩步提升外,還在於美國Summit公司就PD-1/VEGF雙抗依沃西單抗的海外權益支付的約29億元人民幣合作收入。
2022年12月,康方生物將依沃西單抗在美國、加拿大、歐洲和日本的开發和商業化權益,以高達50億美元的總交易額(首付款5億美元)授予美國Summit公司。
值得一提的是,無論和黃醫藥還是康方生物,授權“出海”都取得了开門紅,後續還有不少創新管线等待“出海”。
例如,和黃醫藥的賽沃替尼正在开展聯合奧希替尼治療奧希替尼難治性MET擴增的非小細胞肺癌的Ⅱ期注冊性SAVANNAH研究、Ⅲ期確證性SAFFRON研究,預計2024年內向FDA遞交NDA;另一款具備BIC潛力的索樂匹尼布,已經完成治療成人原發免疫性血小板減少症(ITP)的Ⅲ期試驗,預計2024年內提交NDA,有望成爲全球第二款獲批的Syk抑制劑,並有望實現出海。
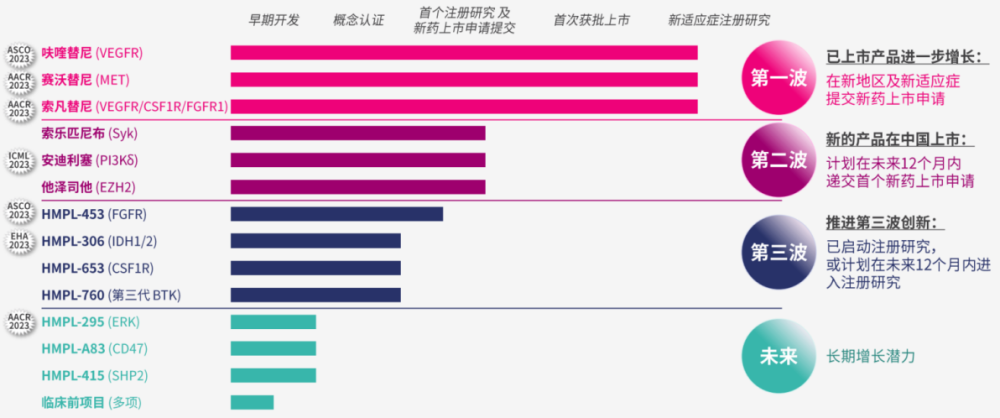
和黃醫藥研發管线
圖片來源:東北證券
康方生物實現出海的產品不止依沃西單抗,去年已將首款上市產品派安普利單抗在澳大利亞、新加坡等東南亞11個國家的獨家銷售權授予ST公司,實現了PD-1單抗差異化出海。
此外,康方生物管线中還有多款潛在海外授權品種,包括全球首個且唯一在研的TIGIT/TGF-雙靶點抗體融合蛋白新藥AK130,同類領先的PD-1/LAG-3雙抗AK129、Claudin 18.2/CD47雙抗AK132、 CD47單抗AK117和CD73單抗AK119等。
04
結語
相信隨着兩會的召开,越來越多的人將關注國產創新藥、創新藥企的新質生產力,加快醫藥產業創新變革,推動高質量發展再上新台階。
參考資料:
1.各家公司的財報、公告、官網
2.德邦證券、東北證券、國海證券、交銀國際研報
@東方財富創作小助手
#百濟神州業績創新高,創新藥概念股活躍#
本文作者可以追加內容哦 !
標題:當“創新藥”首次進入政府工作報告
地址:https://www.utechfun.com/post/342938.html
