8月25日,專注腫瘤治療以及腫瘤疫苗領域的創新藥公司3D Medicines (1244.HK)(以下統稱爲“思路迪醫藥”)發布了公司2023年上半年業績。在繼摘B、納入港股通後,思路迪醫藥成功交出一份營收增長超70%的亮眼答卷。
而在發布業績後第二個交易日,公司股價也跳空高开超9%。那么,這份成績單背後透露了哪些關鍵信息?後續思路迪醫藥又有哪些看點?
營收增長70.3%,虧損收窄
從財務指標上來看,思路迪醫藥商業化產品在市場上有較好的銷售表現,促使公司加速走向盈利。
根據公司公告顯示,2023年上半年公司實現營業收入人民幣3.52億元,同比增長70.3%,主要營收增幅源自核心產品恩維達的銷售收入增加。公司自2021年末核心產品恩維達上市以來,產品銷售在2022年期間开始快速放量,當年營收規模已能夠能夠覆蓋研發开支。在今年5月,思路迪醫藥因市值規模及營收規模均符合聯交所規定,公司股票簡稱正式移除標記“B”,成爲聯交所18A政策執行五年以來第十一家成功摘“B”企業。
截至2023年6月30日,思路迪醫藥營收規模延續2022年快速增長趨勢,已能覆蓋大部分費用,毛利率高達92.3%。今年上半年經調整期內全面虧損總額8145萬元,較同期下降29.9%,虧損進一步收窄。
圖表一:思路迪醫藥2023年上半年業績摘要
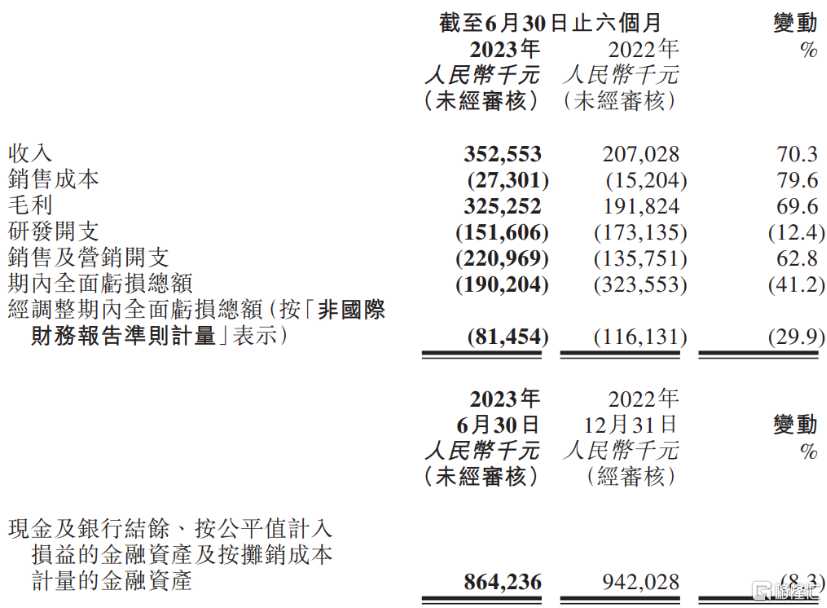
數據來源:公司資料,格隆匯整理
商業化加速:多維探索產品可能性
而在營收加速的背後,離不开思路迪醫藥獨特的商業化模式。
作爲全球首款皮下注射PD-L1抗體藥物恩沃利單抗,思路迪醫藥自恩維達商業化以來便有明確的市場拓展規劃。
一方面,公司上市產品商業化速度快。
2021年11月24日,恩維達在中國獲批,不到十日首批商業化產品就正式發貨。12月8日首張處方在各省市全面落地,適用於不可切除或轉移性微衛星高度不穩定(MSI-H)或錯配修復基因缺陷型(dMMR)的成人晚期實體瘤患者的治療。
僅上市不到兩年,恩維達就已經被列入9項中國臨牀治療指南推薦使用,其中包括6項CSCO臨牀使用指南、1個中國食道癌放射治療指南、1個中華醫學會婦科腫瘤臨牀指南以及1個婦科腫瘤免疫檢查點,爲靜脈不耐受的腫瘤患者解決剛需問題,讓更多患者長期用藥中提高生活質量。
圖表二:恩維達獲得9項指南推薦

數據來源:公司資料,格隆匯整理
另一方面,公司不斷擴展產品可及性,市場空間向上打开。
在國內市場,截至2023年6月恩維達已於30個省及超過200個市的逾1150家醫院及1150個藥店銷售。恩維達已被納入全國32個城市「惠民保」特定高額自費藥品目錄,進一步提高了產品的可及性。
2023年8月24日,恩維達聯合含鉑雙藥化療對比安慰劑聯合含鉑雙藥化療用於可切除III期非小細胞肺癌患者新輔助/輔助治療的隨機、對照、雙盲、多中心III期臨牀研究 (KN035-CN-017)已獲國家藥品監督管理局(NMPA)的臨牀試驗許可。本次研究的獲批意味着恩維達又一適應症進入關鍵臨牀階段,該適應症充分發揮恩維達皮下注射優勢,將惠及更多腫瘤患者。
在海外市場,思路迪醫藥亦取得重大進展。公司於報告期內啓動美國FDA批准的關鍵臨牀試驗,即一項旨在評估恩沃利單抗單藥用於dMMR晚期實體瘤受試者的療效及安全性的多地區、多中心、單臂的II期研究。該項目目前處於篩選研究中心階段,計劃在全球4個地區8個國家69家中心开展,入組200例患者。截至最新,公司正在美國、歐洲、日本及拉丁美洲積極准備入組患者。作爲全球唯一一個皮下注射且不需要特殊器材的皮下注射,其便捷性一定會幫助到更多腫瘤患者。
此外,在探索產品更多適應症及聯合用藥可能性方面,思路迪醫藥亦圍繞恩沃利單抗產品特性开展了多項臨牀試驗。其中,恩沃利單抗聯合甲磺酸侖伐替尼膠囊治療晚期經治內膜癌患者的潛在關鍵新藥療效突出,安全可控,預計8月底前申請與主管當局溝通。恩沃利單抗聯合侖伐替尼用於治療晚期實體瘤的臨牀結果的詳細資料已被歐洲腫瘤學會年會(ESMO)接受爲壁報,並將於2023年10月中旬展示。恩沃利單抗用於治療晚期軟組織肉瘤的關鍵性臨牀研究正在推進中。多維度的探索正在快速推動恩維達適應症的增加,逐漸形成差異化的優勢在同類產品的激烈競爭中獲得更多的市場份額。
與此同時,公司爲加速商業化進程,在生產、銷售等方面做好充分准備。
在生產上,公司購入位於江蘇省徐州市的總面積爲65,637.97平方米的土地使用權,用於建設新生產設施。在公司的規劃中,生產設施的GMP合規制造設施乃根據FDA、EMA及中國國家藥監局的規定設計及驗證。思路迪醫藥使用符合多地標准的GMP,一方面是想要生產設施足以實現從藥物發現至進行开發、GMP合規試點及商業化制造的整個藥物开發過程提供支持。另一方面則是有明確的計劃推動公司國際化進程,前瞻性地從生產設施入手做好產品“出海”的前置准備。
在銷售上,公司已成立專門負責管线商業化部門,腫瘤治療商業化方面具有豐富經驗的團隊負責協商合同及管理分銷商與供應鏈。未來思路迪醫藥的商業化團隊主要負責產品定位、市場策略、推廣活動策劃及患者援助,將會從上市前准備、渠道建設、供應鏈管理等多方位協助公司產品盡快觸及患者。
創新研發,瞄准腫瘤疫苗
實際上,思路迪醫藥的發展不止於此。
思路迪醫藥不僅有已實現商業化的恩維達,還擁有強大的在研產品线,包括12種候選藥物,其中有7款產品處於不同臨牀階段,後續管线看點十足。
在腫瘤免疫治療上,目前3D185已經獲美國FDA授予治療胃癌及胃食管連接處癌以及治療膽道癌的兩項孤兒藥資格認定。隨着上述臨牀試驗進程的推進,將轉化爲思路迪醫藥一個又一個商業化的可能性,持續性爲思路迪醫藥帶來營收,推動公司邁動研發與國際化的步伐。
從管线布局上來看,思路迪醫藥持續深耕腫瘤慢病化賽道,不僅布局腫瘤免疫治療領域,還瞄准了潛力巨大的腫瘤疫苗領域。
腫瘤疫苗是繼腫瘤放化療、靶向治療、和以PD-(L)1爲代表的免疫治療之後的下一代新型治療方式。
目前,思路迪醫藥有兩個多肽腫瘤疫苗在研管线,其中包含未來的潛在核心產品Galinpepimut-S(3D189),有望爲包括血液腫瘤和實體腫瘤在內的20多種癌症治療帶來益處。根據規劃,公司計劃在2023年底前在中國开展該項Ⅲ期臨牀研究及FPI,預期2023年底前加入MRCT,有望獲得FDA授予快速審評資格,獲得FDA用於治療AML、MPM及MM的孤兒藥資格,並獲得歐洲藥品管理局(EMA)授予治療AML、MPM及MM的孤兒藥產品資格。
與此同時,公司還在布局mRNA腫瘤疫苗領域。在新冠期間,全球在研的mRNA腫瘤疫苗已在多種類型的腫瘤治療中取得突破性進展。相比其他技術路线,基於新抗原的mRNA腫瘤疫苗具有特異性高、安全性好、有效性強、免疫持久、研發周期短和規模化生產快等顛覆性優勢,具有個性化治療前景,以及與其他藥物聯用的更多發揮空間。
2023年8月26日,公司宣布與具有豐富的mRNA疫苗研發和工藝放大經驗的翊斯生物合作开發下一代mRNA腫瘤疫苗,爲腫瘤患者活得更久更好提供更多的治療方法。本次合作將豐富思路迪醫藥腫瘤疫苗系列管线,多肽腫瘤疫苗與mRNA腫瘤疫苗並駕齊驅,實現腫瘤慢病化領域的更強布局。
圖表三:思路迪醫藥管线候選藥物臨牀开發狀況

數據來源:公司資料,格隆匯整理
小結
從政策面上來看,頂層設計依舊鼓勵創新藥企蓬勃發展。在國務院最新發布的《醫藥工業高質量發展行動計劃(2023-2025年)》中指出,“要着眼醫藥研發創新難度大、周期長、投入高的特點,給予全鏈條支持,鼓勵和引導龍頭醫藥企業發展壯大,提高產業集中度和市場競爭力。”
如今,科學發展速度加快,腫瘤治療也正在呈現慢病化趨勢。而作爲創新藥企的佼佼者,思路迪醫藥正是瞄准其中巨大發展潛力,不僅在腫瘤免疫治療中通過差異化創新取得突出成績,更在腫瘤疫苗等新興賽道加速布局,第二條增長曲线已然开啓。
在依舊存在諸多不確定性的2023年,思路迪醫藥一方面擁有強大的商業化管线,爲其帶來穩定現金流,另一方面不少重磅管线持續推進也將成爲公司發展的重要催化劑。根據公司規劃,未來三至五年內持續有產品面世。屆時,公司多維度努力形成的潛力將會轉化爲實力,推動公司業績走入快速增長的通道,值得期待。$3D MEDICINES(HK|01244)$
本文作者可以追加內容哦 !
標題:思路迪醫藥(1244.HK):營收增長70%,下注腫瘤疫苗
地址:https://www.utechfun.com/post/254638.html
