導讀 10月12日,據 CDE 官網顯示,諾華(NVS.US)遞交的 BCR-ABL 變構抑制劑 Asciminib 新臨牀試驗申請獲默示許可(受理號:JXHL2300178),用於治療慢性髓性白血病(C...
10月12日,據 CDE 官網顯示,諾華(NVS.US)遞交的 BCR-ABL 變構抑制劑 Asciminib 新臨牀試驗申請獲默示許可(受理號:JXHL2300178),用於治療慢性髓性白血病(CML)患者;急性淋巴細胞白血病(ALL)患者。
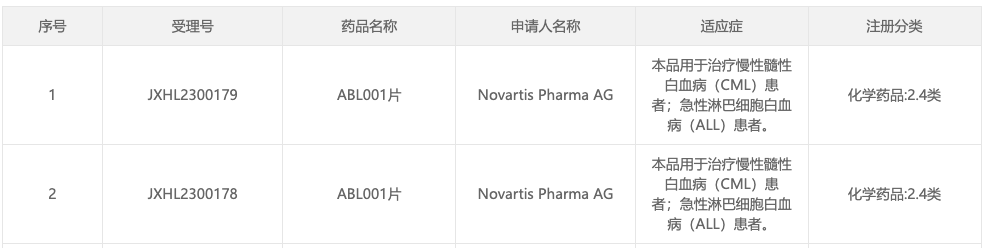
據了解,Asciminib 於 2021 年10月獲 FDA 加速批准上市,用於既往接受至少兩種 TKI 治療的費城染色體陽性 CML 慢性期(Ph+ CML-CP)成人患者,並完全獲批用於 T315I 突變型 Ph+ CML-CP 成人患者。此後,又分別於 2022 年 3 月、8 月,在日本、歐盟獲批上市。
在國內,於 2021 年 3 月首次啓動臨牀,針對慢性髓系白血病,目前正在开展 4 項臨牀試驗,包括一項 10 月 4 日在ClincalTrials.gov 平台上登記啓動的 I/II 期臨牀試驗(登記號:NCT04925479),目前暫未在 CDE 臨牀試驗平台登記啓動。其中,III 期臨牀試驗(登記號:NCT04971226)當前已完成所有受試者的招募工作,該研究旨在對比 Asciminib 和 TKI 療法用於新確診的 Ph+ CML-CP 患者的臨牀療效。
追加內容
本文作者可以追加內容哦 !
標題:諾華(NVS.US)BCR-ABL變構抑制劑國內獲批新臨牀
地址:https://www.utechfun.com/post/276429.html
